PREPARAZIONE E NOMENCLATURA DEI SALI - ppt video online scaricare
PREPARAZIONE DEI SALI NEUTRI I Sali sono dei composti chimici che nella loro molecola contengono sia un elemento a comportamento metallico sia un elemento a comportamento non metallico. Pertanto essi si formano dalla combinazione di elementi o di composti che presentano le suddette caratteristiche. I Sali a seconda del numero di specie chimiche presenti si possono dividere in: SALI BINARI a due componenti SALI TERNARI a tre componenti SALI QUATERNARI a quattro componenti A seconda della composizione in : SALI NEUTRI SALI ACIDI SALI BASICI
PREPARAZIONE E NOMENCLATURA DEI SALI
SALI BINARI. SALI NEUTRI. SALI TERNARI. SALI ACIDI. SALI QUATERNARI.
I Sali sono dei composti chimici che nella loro molecola contengono sia un elemento a comportamento metallico sia un elemento a comportamento non metallico. Pertanto essi si formano dalla combinazione di elementi o di composti che presentano le suddette caratteristiche. I Sali a seconda del numero di specie chimiche presenti si possono dividere in: SALI BINARI a due componenti. SALI TERNARI a tre componenti. SALI QUATERNARI a quattro componenti. A seconda della composizione in : SALI NEUTRI. SALI ACIDI. SALI BASICI.
Metallo + non metallo = Sale. Metallo + Anidride = Sale. Non metallo + Ossido = Sale. Ossido + Anidride = Sale. Ossido + Acido = Sale. Anidride + Idrossido = Sale. Idrossido + Acido = Sale. Idrossido + non metallo = Sale. Acido + Metallo = Sale.
Per preparare un sale ternario neutro è opportuno partire dal nome con cui viene denominato, facendo un percorso a ritroso per l’identificazione dei composti interessati al processo di formazione. Per tale operazione si procede nel seguente modo: osservare la desinenza del nome dell’elemento non metallico del sale, che ci dà informazioni sul valore della valenza iniziale del non metallo; preparare l’anidride e il rispettivo acido di derivazione; preparare l’ossido e l’idrossido che contengono il metallo del sale; 4. una volta preparati i suddetti composti si fa reagire, il composto che contiene il metallo e quello che contiene il non metallo. ESEMPIO : IDROSSIDO + ACIDO SALE.
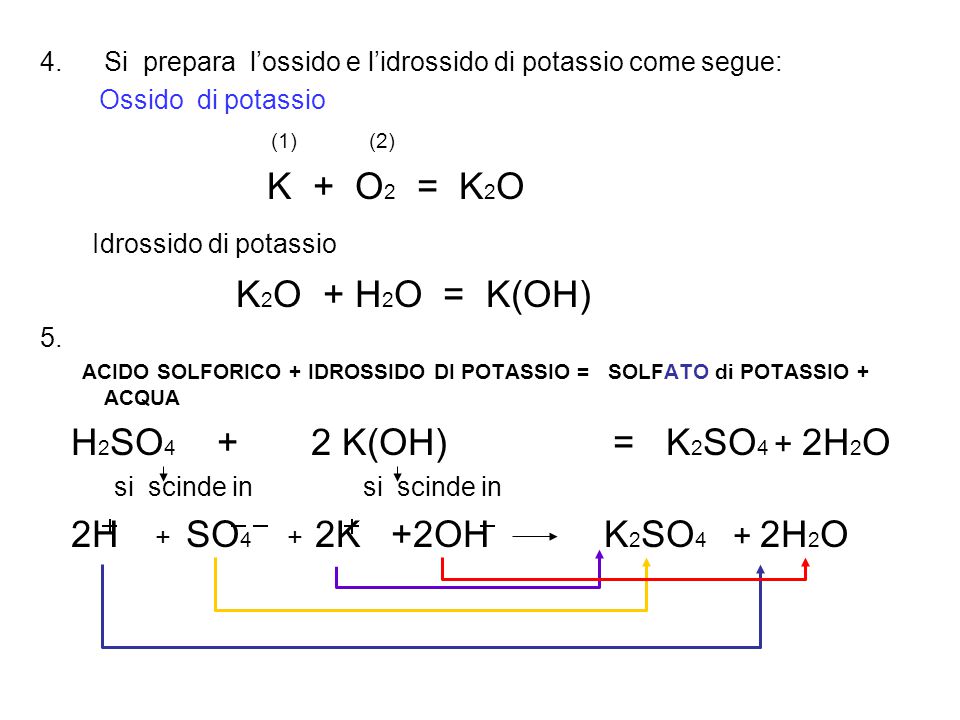
Il solfato di potassio è un sale ternario neutro che contiene un non metallo (zolfo S) e un metallo (potassio K). Si osserva la desinenza del non metallo che è .. ato, il che significa, che il sale deriva da un acido che ha una desinenza in .. .ico, e un’anidride con desinenza in ..ica. In tal caso lo zolfo è stato preso con la valenza maggiore (6) tra quelle con cui si presenta (2 – 4 – 6). 2. si prepara Anidride solforica. (6) (2) S + O2 SO3. Si prepara l’acido solforico. SO3 + H2O H2SO4.
Si prepara l’ossido e l’idrossido di potassio come segue: Ossido di potassio. (1) (2) K + O2 = K2O. Idrossido di potassio. K2O + H2O = K(OH) 5. ACIDO SOLFORICO + IDROSSIDO DI POTASSIO = SOLFATO di POTASSIO + ACQUA. H2SO4 + 2 K(OH) = K2SO4 + 2H2O. si scinde in si scinde in. 2H + SO4 + 2K +2OH K2SO4 + 2H2O.
Se il non metallo è polivalente, cioè ha valenze , avremo. VALENZA ANIDRIDE DERIVATA ACIDO DERIVATO SALE DERIVATO NOME METAL. NON METALLO. 1 ANIDRIDE IPO …OSA ACIDO IPO …OSO IPO…..ITO di Me. 3 ANIDRIDE …….OSA ACIDO … OSO ………ITO di Me. 5 ANIDRIDE …..… ICA ACIDO …..… ICO ………ATO di Me. 7 ANIDRIDE PER… ICA ACIDO PER…ICO PER….ATO di Me.
Per comprendere le modalità con le quali si formano i Sali, bisogna immaginare i reagenti dissociati in un solvente sotto forma ionica. Nel caso specifico, l’acido per caratteristiche proprie, libera ioni H+, mentre il radicale acido SO4 -- non si scinde in acqua, in quanto il legame tra S e O è di tipo covalente. L’ Idrossido solubile in acqua si scinde completamente in K+ e OH- In fase di ricomposizione gli ioni si riaggregano seguendo la maggiore differenza di elettronegatività presente tra i vari componenti, per cui, il potassio K , che è più elettropositivo dell’ idrogeno H, si aggregherà prima all’ossigeno del radicale acido, che tra gli elementi presenti è quello più elettronegativo. Inoltre essendo il numero di ossidazione del radicale acido SO4, - 2 , occorrono 2 ioni K+ per saturali e costituire la molecola. VEDI SEQUENZA ANIMATA NELLA DIAPOSITIVA SUCCESSIVA CLICCANDO SUL MOUSE.
Idrossido di Potassio KOH. Acido Solforico H2SO4. O. K. O. H. H. S. K2SO4. 2 H2O. Solfato di potassio. Acqua. Clicca più volte X costruire la molecola.
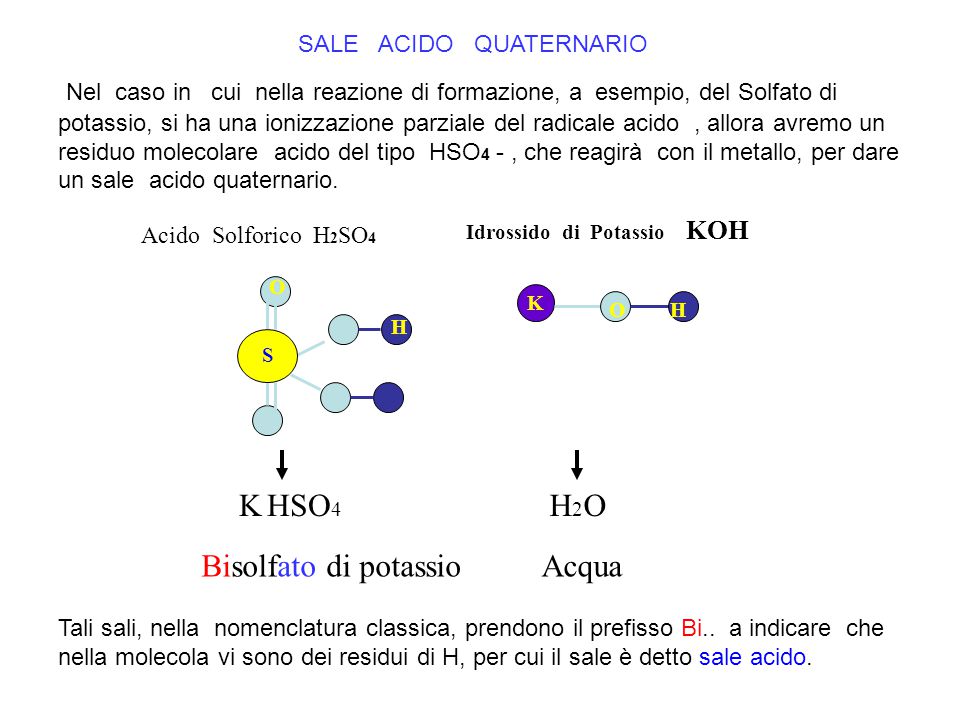
Nel caso in cui nella reazione di formazione, a esempio, del Solfato di potassio, si ha una ionizzazione parziale del radicale acido , allora avremo un residuo molecolare acido del tipo HSO4 - , che reagirà con il metallo, per dare un sale acido quaternario. Idrossido di Potassio KOH. Acido Solforico H2SO4. O. K. O. H. H. S. K HSO4. H2O. Bisolfato di potassio. Acqua. Tali sali, nella nomenclatura classica, prendono il prefisso Bi.. a indicare che nella molecola vi sono dei residui di H, per cui il sale è detto sale acido.
SALE NEUTRO BINARIO. I Sali binari sono quei sali in cui sono presenti solo il metallo e il non metallo. Generalmente si formano dalla reazione di un Idracido con un composto che contiene il metallo. H2 + Cl2. HCl. Acido Cloridrico. (Acido binario) Na2 O + HO2. Na OH. Idrossido di Sodio. Cloruro di Sodio. + Acqua. HCl. + Na OH. + Na. H. + + La nomenclatura classica prevede che la desinenza in ..idrico dell’Idracido si trasformi in ..uro nel sale. Pertanto dall’acido Cloridrico avremo il cloruro di.. Cl. - OH. - Clicca X costruire le molecole.

Sali. Definizione, formula generale e nomenclatura. Prima parte.

NOMENCLATURA DEI SALI
PREPARAZIONE E NOMENCLATURA DEI SALI - ppt video online scaricare

INTORNO A TE by Mondadori Education - Issuu

La Nomenclatura Chimica - ppt video online scaricare
PREPARAZIONE E NOMENCLATURA DEI SALI - ppt video online scaricare

Lezioni di chimica - Nomenclatura - 8 (anioni, cationi, sali

Ossiacidi L8 - Chimica Generale - @ManueleAtzeni ISCRIVITI

Guida dello Studente a.a. 2010-2011 - Facoltà di Medicina

Nomenclatura chimica

66156_UN_SOLO_PIANETA by Mondadori Education - Issuu
La Nomenclatura Chimica - ppt video online scaricare








